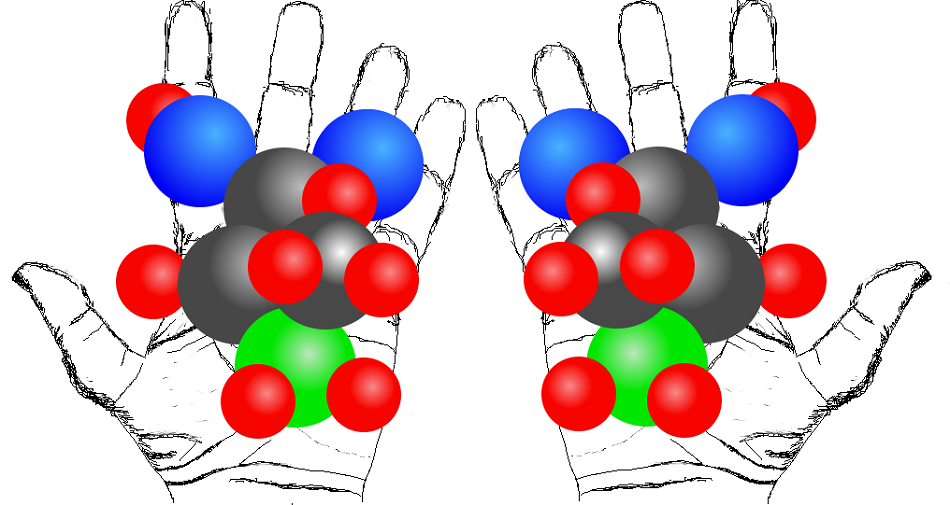
Účinnost elektrolýzy vody snižuje vznik peroxidu vodíku H202 jako vedlejšího produktu. Vzniká spojením dvou radikálů OH., ke kterému může dojít jenom, pokud nepárové elektrony v obou radikálech mají opačný spin (kvantový vnitřní moment hybnosti). Pokud by na anodě vznikaly pouze radikály OH. s paralelními spiny, produkce peroxidu vodíku by výrazně poklesla a účinnost elektrolýzy vody na vodík a kyslík by vzrostla. Přesně k tomu dojde, když povrch elektrody z oxidu titaničitého TiO2 pokryjeme jedním izomerem chirální organické polovodivé molekuly, konkrétně triarylaminy nebo porfyriny se zinečnatým kationtem Zn2+. Chirálními nazýváme molekuly stejného složení a struktury, pokud existují ve dvou strukturách, které se k sobě mají jako předmět a jeho obraz v zrcadle. Zároveň není možné je ztotožnit žádným pohybem, např. otáčením. Zpravidla jde o sloučeniny s atomem uhlíku, na který se váží čtyři odlišné skupiny. Typický příklad je molekula aminokyseliny alaninu CH3CH(NH2)COOH, jejíž dvě možné chirální struktury vidíme na obrázku. Šedivé koule značí atomy uhlíku, modré kyslíku, zelené dusíku a červené vodíku.




